팁 1 : 왜 원자는 중립입니까?
팁 1 : 왜 원자는 중립입니까?
원자 핵과 전자로 이루어져있다. 핵은 실질적으로 원자의 전체 질량을 포함하지만, 체적의 무시할 수없는 부분만을 차지합니다. 전자는 원형 및 타원형 궤도를 따라 핵 주위를 회전하여 전자 껍질을 형성합니다. 이 원자 구조는 가장 얇은 금판을 통해 X 선이 통과하는 동안 입자의 편향을 연구 한 과학자 러더퍼드 (Rutherford)의 실험에 의해 확인되었습니다. 각 전자는 단위 음전하를 띠고있다. 연구가 확인한 것처럼 원자는 왜 중립적인가?
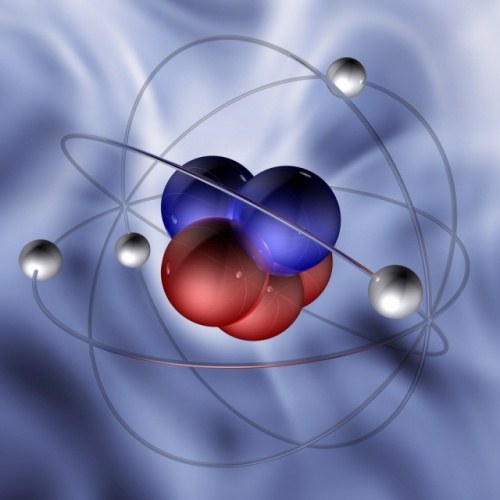
팁 2 : 양성자를 찾는 방법
Atom은 일종의 축소 형 복사본입니다.태양계. 그 중심에있는 태양 대신 단지 거대한 핵이 있으며, 행성 대신에 기본 입자 - 전자 -가 회전합니다. 원자는 전기적으로 중성이므로 전자의 총 음전하는 같은 크기의 총 양전하에 의해 균형을 이루어야합니다. 코어는 다른 기본 입자 - 양성자와 중성자 -로 구성되기 때문에 이런 일이 발생합니다. 각 양성자는 전자와 같은 전하를 띠고 반대 부호 만 가지고 있습니다.

지침
1
문제의 상황을 알고 있다고 가정합시다.원자핵의 전체 양전하 Q. 양성자 수 N을 알아 내기 위해서는 Q를 양성자 전하 qpr의 크기로 나누면됩니다. (그것은 물리학이나 화학에 대한 핸드북에서 찾을 수 있습니다). 즉, N = Q / qpr이다.
2
커널에서 양성자의 수를주기율표. 이 표에서 각 요소는 화학적 특성에 따라 엄격히 정의 된 특정 위치에 지정됩니다. 그리고 화학적 성질은 원소의 원자 구조에 의해 결정됩니다.
3
테이블의 각 셀에는 일련 번호를 포함하여 화학 원소에 대한 필요한 정보가 들어 있습니다. 여기서는 원소의 원자핵에있는 양성자의 수에 해당합니다.
4
테이블을 봐. 원소 번호 11 - 알칼리 금속 나트륨 (Na). 결과적으로, 각 나트륨 원자에는 11 개의 양성자가있다. 또는 원소 번호 23은 바나듐 금속 (V)이며, 화합물의 염기성은 물론 산성을 나타냅니다. 그들의 서수에 기초하여, 우리는 결론을 내릴 수있다 : 각 바나듐 원자에서 23 개의 양성자가있다.
5
일종의 검증을하십시오. 원자는 전기적으로 중성 인 것으로 알려져있다. 그러나 중성자는 전하를 전혀 운반하지 않기 때문에 전자 만 원자 양성자의 총 양전하를 균형있게 잡을 수 있습니다. 그러므로, 나트륨 원자와 바나듐 원자에서 11 개의 전자가 존재해야합니다. 23. 이것이 그렇게되는 지 확인하십시오.
6
다시, 주기율표를 취하십시오. 각 셀에는이 원소의 전자 수준이 채워지는 방식을 보여주는 데이터가 들어 있습니다. 나트륨 : 첫 번째 레벨의 두 전자, 두 번째 레벨의 전자 8 개, 세 번째 레벨의 전자 8 개 (외부). 총 11 개의 전자가 있습니다. 바나듐 : 첫 번째 단계에서 두 개의 전자, 두 번째 전자는 8 개, 두 번째 전자는 11 개, 세 번째 전자는 11 개, 네 번째 전자는 두 개입니다. 총 23 개의 전자들. 총 전하량은 균형을 이루고 원자는 전기적으로 중성입니다.







